研究内容
生命分子間の相互作用は、非共有結合の組み合わせによる特異的な多点結合により形成されている。本研究室ではこれらの相互作用への寄与を明らかにするために、蛋白質間相互作用全般、抗体-抗原、受容体-リガンド、蛋白質-金属イオン、多量体形成蛋白質など様々な蛋白質を題材とした解析を行っている。アミノ酸等を用いた溶媒制御によって蛋白質をハンドリングしながら、部位特異的変異導入を活用し、等温滴定型熱量測定(ITC)、表面プラズモン共鳴測定(SPR)、示差走査型熱量測定(DSC)、示差走査型蛍光測定(DSF)、マイクロスケール熱泳動(MST)等の物理化学的手法を用いた速度論的/熱力学的解析、円偏光二色性測定(CD)をはじめとした分光学的解析、さらには質量分析および結晶構造解析といった手法を駆使して、多角度的に生命分子間相互作用を精密解析し議論することにより、特異性・親和性創出機構の解明を試みている。得られた物理化学的パラメータは、計算・情報科学を駆使することにより分子のダイナミクスやアンサンブルの観点を取り入れることにより、in vitroとin silicoを融合して医療・材料応用を目指した蛋白質設計や低分子設計にチャレンジしている。これらの知見を踏まえ、高機能かつ優れた物性を持つ機能性分子の開発や特定の分子間相互作用を制御する分子種の探索を通じて創薬基盤の構築へと繋げるとともに、生命における“相互作用”の本質を理解することを目指している。
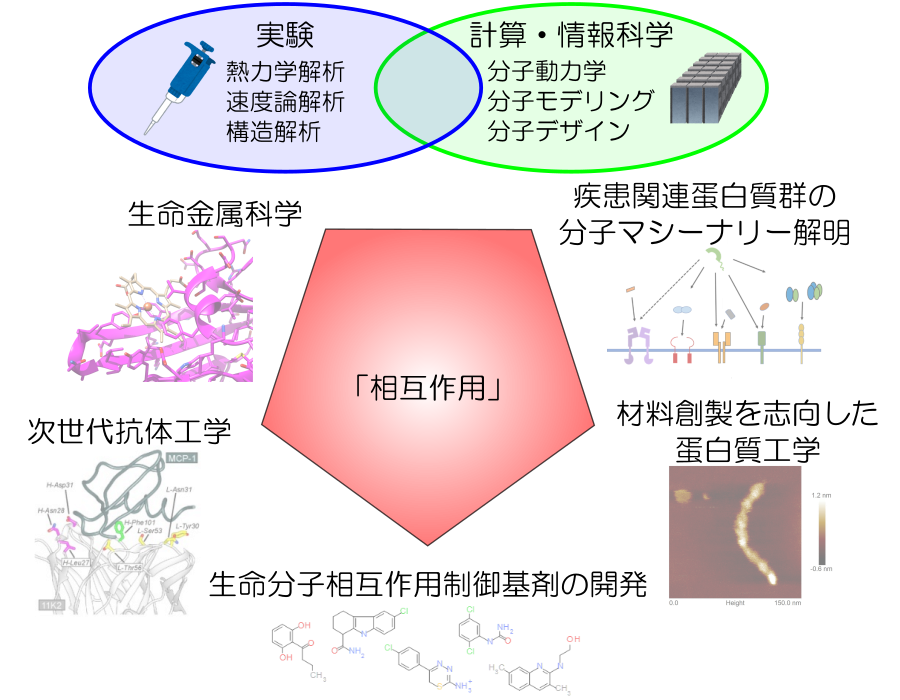
研究項目
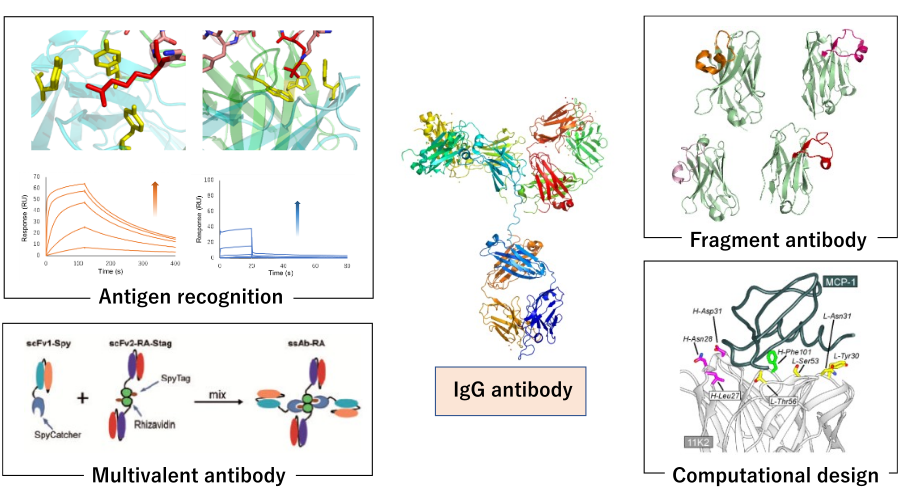
次世代抗体工学
抗体は、抗原分子を高い親和性と特異性で認識する能力から、バイオ医薬品や診断薬として広く用いられています。近年、抗体医薬品を中心としたバイオ医薬品市場は拡大を続け、次世代抗体には、さらなる物性向上や高機能化が求められています。津本研究室では、抗体の抗原認識機構を多角的に解析し、蛋白質工学技術を駆使することで、次世代抗体分子の創製に貢献する研究を進めています。特に近年は、計算科学と実験技術を組み合わせることで、従来は困難であった抗体設計や親和性向上を効率的に行う研究に力を入れています。
具体的には、抗体の抗原認識や熱安定性、凝集性などの物性について、SPR、ITC、CDなどの物理化学的解析、X線結晶構造解析による構造解析に加え、細胞生物学的手法を組み合わせ、分子レベルでの詳細な理解を目指しています。さらに、ファージディスプレイ、cDNAディスプレイなどの進化工学技術を駆使した抗体改変、単ドメイン抗体(VHH)の開発、抗体の小型化、融合抗体の作製、計算科学を用いた合理的デザインによる抗体機能改変に取り組んでいます。最近では、抗体の設計・評価を加速化するために、ハイスループットスクリーニング技術やデータ駆動型設計を取り入れた研究にも注力しています。
研究テーマ例
- 抗体の分子認識メカニズムの解明:蛋白質抗原から翻訳後修飾特異的抗体など
- 生化学的・構造生物学的手法を組み合わせた抗体エンジニアリングによる機能向上
- ハイスループットスクリーニング技術とデータ駆動型設計を融合した抗体開発基盤の構築
- 多様な分子認識機構を基盤とした新規抗体フォーマットの開発
- 計算科学に基づいた抗体デザイン技術開発(分子動力学計算、自由エネルギー計算など)
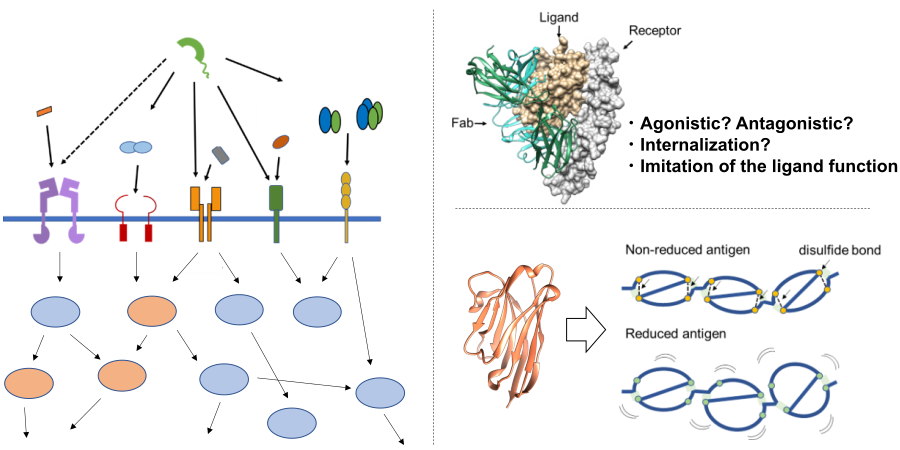
疾患関連蛋白質群の分子マシーナリー解明
蛋白質は、生体内において様々な生体分子と相互作用することで複雑な生命システムを構築しており、その緻密に制御されたシステムの破綻が、がんや自己免疫疾患、神経変性疾患などの様々な疾患を引き起こします。例えば、生体内の種々のがん抑制蛋白質は細胞の恒常性を維持する役割を担っていますが、その発現量が低下する、あるいは配列に変異が加わることによりその機能が破綻し、発がんへとつながります。また、個々の生体内にとどまらず、感染症を引き起こす病原性微生物と宿主の間においても多様な蛋白質が相互作用しており、近年重大な社会問題となっている新型コロナウイルスの感染においてもヒトの細胞表層に発現する受容体とウイルス表面の蛋白質との相互作用が重要な役割を果たしています。津本研究室では、様々な疾患に関連する蛋白質群に着目し、それらが織りなす分子マシーナリーを紐解くことで、疾患のメカニズムを分子レベルで解明することを目指しています。物理化学的解析や構造解析、細胞生物学的解析、分子動力学シミュレーションなどの様々な手法を用いて疾患関連蛋白質の分子機能を多角的に解析するとともに、そこから得られた知見に基づく、抗体や中分子、低分子などの各種モダリティ分子を用いた蛋白質機能制御を目指した研究を展開しています。
研究テーマ例
- がん抑制蛋白質の分子機能メカニズムの解析と分子改変
- がん抑制蛋白質の分解機構の解明と阻害剤探索
- シナプス形成関連蛋白質の構造機能解析と制御分子の開発
- 細胞外マトリックスおよび細胞接着因子の分子機構解析と機能制御分子の開発
- 自己免疫疾患における自己抗体による抗原認識機構の解析
- 病原性微生物蛋白質の表層蛋白質の機能解析と阻害剤探索
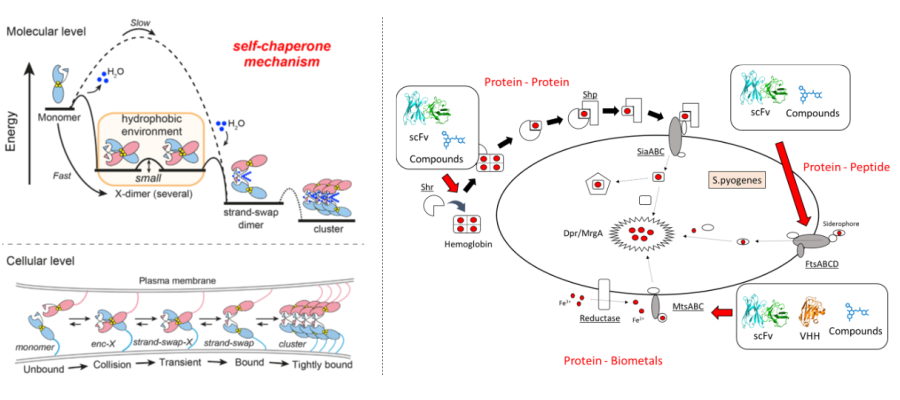
生命金属科学
金属は、蛋白質の機能に不可欠な要素であり、その相互作用は生命現象の根幹をなしています。ヒトを含む動植物から微生物まで、多様な生物が持つ蛋白質は、その機能発揮に金属を必要とし、その制御の乱れが疾患につながることが知られています。例えば、金属依存的に活性化する蛋白質の制御異常は、がんの発生や転移を促進する可能性があり、その制御を正常化することで治療につながることが期待されます。また、病原性微生物が宿主から金属を獲得する巧妙なメカニズムを解明し、それを制御することで、新しい作用機序を持つ抗菌薬の開発に繋がると考えられます。すなわち、生命における蛋白質機能と金属の関係性を明らかにすることは、「生命」の理解を深め、様々な疾患の治療法開発へと繋がります。津本研究室では、金属が関与する細胞間接着、金属輸送、病原性微生物の金属取り込み機構に着目し、金属を介した蛋白質機能の解明と制御を目指した研究を展開しています。特に近年は、X線結晶構造解析や質量分析、分子動力学シミュレーションなどの多様な手法を組み合わせることで、複雑な金属-蛋白質相互作用のメカニズムを原子レベルで解明することに力を入れています。
研究テーマ例
- 金属依存的な細胞接着蛋白質の会合体形成機構の解明と制御
- 病原性微生物における金属獲得機構の解明と阻害剤開発
- 金属結合蛋白質の分子認識機構解明と標的蛋白質選択的な抗体開発
生命分子相互作用制御基剤の開発
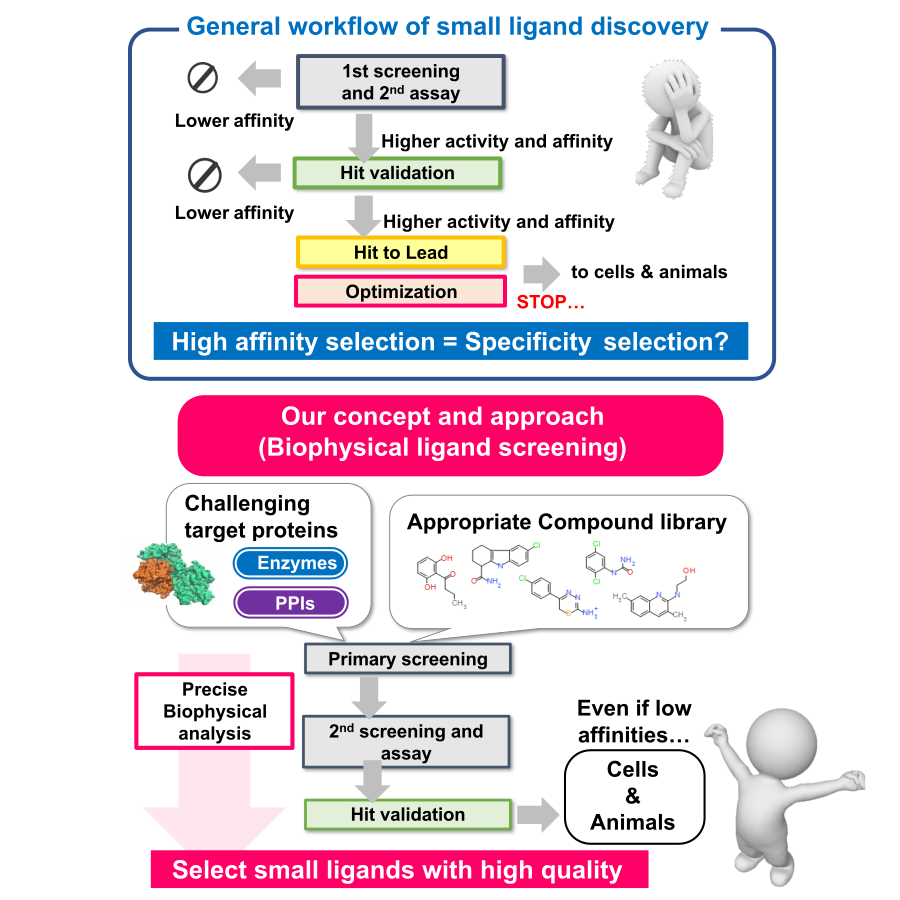
津本研究室では、細胞内シグナル伝達や代謝制御に関わる蛋白質の相互作用を標的とした低分子リガンドの創出に取り組んでいます。近年の創薬研究では、細胞膜蛋白質、蛋白質間相互作用(PPI)、天然変性蛋白質といった、従来の創薬技術では対応が難しい標的分子の割合が増加しています。そこで、本研究室では、様々な物理化学的解析技術(ITC、SPR、DSC、MST、HDX-MSなど)を駆使して、生命分子の物性を正確に評価し、その相互作用の“質”を定量的に解析することにより、難易度の高い標的分子に対する新規リガンドの探索を行っています。フラグメントライブラリー、PPIライブラリー、天然物ライブラリーなど、多様な化合物ライブラリーを活用し、本学の創薬機構DDIやAMED創薬支援事業と密に連携しながら、治療薬開発のみならず、生命科学研究に貢献する機能性低分子リガンドの創出を目指しています。
研究テーマ例
- 標的分子と低分子化合物との相互作用を詳細に解析する技術開発
- PPI阻害剤の合理的な設計、最適化に向けた研究
- 天然変性蛋白質に対する低分子化合物の探索
- ペプチド骨格をベースにした新規機能性分子設計
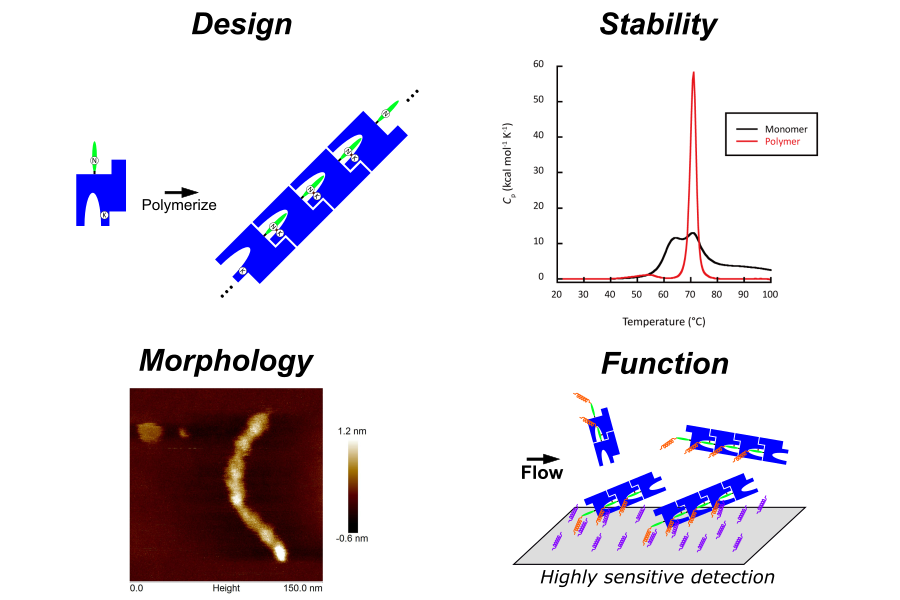
材料創製を志向した蛋白質工学
蛋白質は、生命活動を担う基本的な構成要素であると同時に、高度な自己組織化能や特異的な分子認識能といった、他の物質にはないユニークな性質を備えています。このため、医薬品分野はもちろんのこと、エネルギー、環境、先端材料など、幅広い分野での応用が期待されています。津本研究室では、生物を構成する蛋白質の多様な機能と優れた特性に着目し、そのアミノ酸配列を精密に再設計することで、従来の材料にはない新しい機能や性能を持つ、革新的なバイオマテリアルの開発を目指した研究を行っています。
研究テーマ例
- 抗体のスーパーチャージデザインと検出材料への応用
- 微生物由来接着蛋白質の分子内/分子間架橋結合を利用した共有結合性バインダーの設計
- 抗体分析カラムに用いるリガンド蛋白質の開発
計算・情報科学に基づく生体分子の解析
上記の各研究テーマに関連して、津本研究室では、医科学研究所のスーパーコンピュータを活用し、計算科学と情報科学に基づいた生体分子の解析を積極的に進めています。計算機を用いることで、蛋白質や複合体の立体構造や動的挙動を予測し、分子間相互作用のエネルギーを定量的に評価できます。また、実験では難しい、大規模な変異体解析も効率的に行うことが可能です。例えば、特定の蛋白質の各アミノ酸残基を他のアミノ酸に変えた場合の蛋白質の物性をコンピュータ上で網羅的に解析できます。さらに、分子動力学シミュレーションや自由エネルギー計算を駆使し、実験では解明が難しい分子レベルでの詳細なメカニズムの解明にも取り組んでいます。これらの計算結果に基づいて実験を進めることで、より合理的に生命における“相互作用”の本質を理解し、新規バイオ医薬品の開発や材料創製に繋げることを目指しています。




